3D打印多孔钽表面改性及功能化研究进展
发布时间:
2025-09-04
人口老龄化导致骨骼肌肉疾病的患病率逐年增长,其中骨缺损为骨科最常见的疾病,是由严重的肢体创伤、骨感染、肿瘤和骨髓炎等引起的部分骨骼缺失,全球每年进行的骨移植手术超过200万例[1]。大节段性骨缺损或临界性骨缺损仍是临床治疗的棘手问题,当骨缺损超越骨骼自愈尺度时,需要在缺损部位植入骨修复材料来干预治疗[2-3]。目前应用于骨缺损的修复材料主要有自体骨、同种异体骨和人工骨修复材料,其中自体骨供区有限,且易造成供区损伤,而同种异体骨移植后可能会引起免疫排斥反应、疾病交叉感染等相关并发症[4]。在众多人工骨修复材料中,金属钽(Ta)因具有良好的生物相容性、适宜的机械性能、优异的骨传导性和骨诱导性,在创伤后骨缺损的修复治疗中具有广阔的应用前景[5]。
与传统医用钛合金相比,Ta植入物表现出更好的耐腐蚀性、生物相容性和成骨性能[6-7]。但是随着更深入的临床应用,Ta植入物也逐渐暴露出一系列缺点,如Ta的高密度(16.68g/cm3)和高熔点(3200K)导致其加工性能较差,同时应力屏蔽效应、表面生物惰性、成本高等缺点也限制了其广泛应用。
增材制造技术(AM)制备的多孔Ta具有与人体松质骨相似的多孔结构和弹性模量。一方面,其开放连通的多孔结构利于骨组织长入,在早期实现有效的生物固定;另一方面,接近于人体骨组织的弹性模量降低了应力屏蔽效应,适合作为承重部位的骨替代材料[8-9]。相比于美国Zimmer公司利用化学气相沉积技术(CVD)制备的骨小梁金属植入物(TrabecularMetalTM),AM多孔Ta植入物具有工艺简单、结构可控、可个性化设计等优点[10]。此类个性化种植体在表面化学、拓扑结构、力学性能等方面的精确和个性化控制将极大程度地促进骨组织再生,满足不同骨缺损临床患者的需求[9,11]。尽管如此,AM多孔Ta种植体在国内外的研究尚处于起步阶段。随着骨科植入手术数量的增加,发现患者仍面临骨整合不良、细菌感染、植入物具有表面惰性等风险。近年来,为实现AM多孔Ta植入物的功能化,研究者们通过表面改性方法和拓扑结构优化提供了解决思路。文中对AM多孔Ta的多种表面改性方法及其特点进行了综述,并进一步总结了AM多孔Ta的拓扑结构设计对生物功能化的影响,最后对功能化AM多孔钽的发展和临床应用进行了展望。
1 多孔钽的表面改性方法
生物材料的表面特性直接影响生物相容性和组织整合能力。材料表面的形貌、粗糙度、化学成分、电荷密度对材料–细胞相互作用产生影响,进而改善骨–种植体界面的结合质量,促进植入体的初期稳定性[12-13]。目前针对多孔Ta的表面改性方法主要有碱热处理、阳极氧化、仿生无机涂层、有机涂层、缓释给药涂层和抗菌涂层,表1总结了AM多孔钽的各种表面改性方法及其优缺点[14-21]。
1.1 阳极氧化
阳极氧化法成本低廉、工艺简单、纳米形貌易于操作和控制,常被用于多种金属氧化物体系的纳米多孔结构制备。具体而言,通常以Ta为阳极、铂(Pt)为阴极,在电解液中发生氧化还原反应,在该过程中Ta表面可以形成纳米管、纳米多孔、纳米窝,其主要成分为Ta2O5[16-17]。纳米级多孔氧化薄膜能够增大材料与骨组织的接触面积,从而增强蛋白质、离子、细胞的润湿性和吸附性。大部分研究主要集中于Ta及多孔Ta表面阳极氧化后的物理、化学和生物学性能。Wang等[18]通过阳极氧化在纯Ta表面制备了高度有序的纳米管薄膜,发现Ta2O5纳米管薄膜具有较好的抗腐蚀性能,并且能够增强Ta表面的蛋白吸附,促进兔骨髓间充质干细胞的黏附、增殖和分化,提高成骨相关因子(碱性磷酸酶(ALP、I型胶原蛋白(Collagen–I)、骨钙素(Osteocalcin))的表达水平。

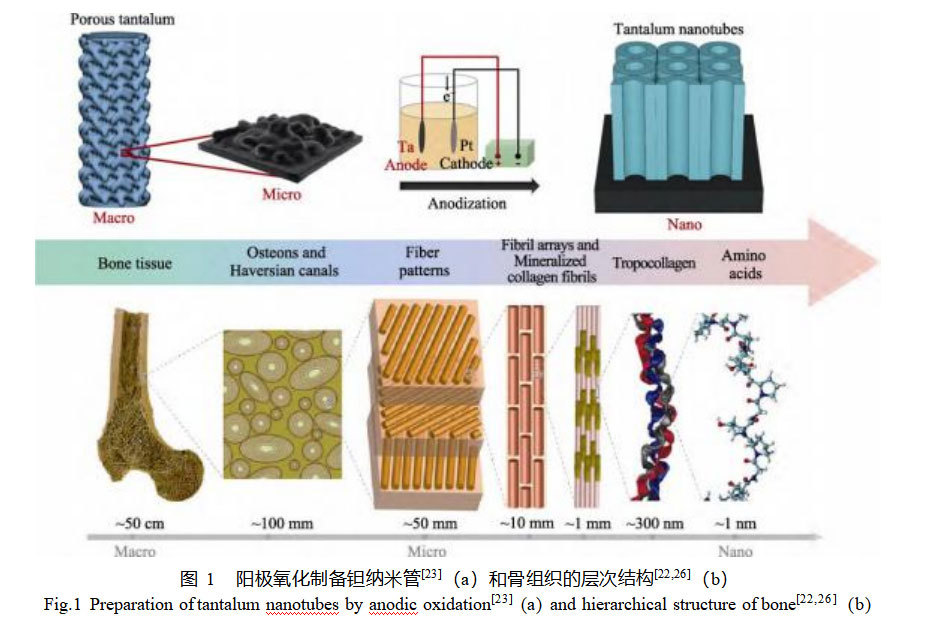
骨具有从宏观到纳米层次水平的分层结构(图1a),主要由较软的胶原蛋白和较硬的磷灰石矿物组成,因此骨骼兼具一定的强度和韧性,是一种可以承载大载荷的轻质材料[22]。理想的骨科植入物应具有与人骨组织相似的微观结构和力学环境,模拟天然骨成为开发新型骨组织工程支架材料的关键策略。为此,多数研究通过控制阳极氧化工艺参数如电压、电解液成分、温度、电流等,对多孔Ta表面形貌进行修饰,以获得类似于人体骨骼的微/纳多孔层。Zhang等[23]采用选区激光熔融(SLM)技术制备了微梯度多孔Ta支架,并通过阳极氧化在多孔Ta表面制备出Ta纳米管(图1b),实验结果表明:多孔Ta的微/纳分层结构在体外和体内均有促进成骨的效果。小鼠胚胎前成骨细胞(MC3T3–E1)的丝状伪足可以进入Ta纳米管并形成连锁单元结构,与未经阳极氧化的多孔Ta组相比,成骨标记基因上调约3~4倍。植入兔股骨7周后,相较于对照组,其早期骨整合性能显著增强。此外,另一项研究[24]也表明,相比单纯的微孔Ta,在微孔Ta表面制备Ta2O5纳米管能够促进人骨髓间充质干细胞的黏附和增殖,成骨基因水平上调1.5~2.1倍。Ta2O5纳米管也可以在无酸电解液中形成,Fialho等[25]在无HF电解液(乙二醇、水、氟化铵)中,通过一步阳极氧化法制备出规则有序的Ta2O5多孔表面,但其物理和生物特性是否比利用含HF电解质制备的氧化层更具优势还需进一步研究。从生物力学角度来看,纳米多孔表面可以有效调节细胞的生长和取向;从物理仿生的角度来看,这些Ta2O5纳米管阵列的表面结构模仿了天然骨组织复杂的几何形状,为细胞的生长提供了多孔网状结构。在未来的临床应用中,具有仿生微/纳梯度结构的3D打印多孔Ta在改善种植体骨整合方面具有很好的应用前景。
尽管通过阳极氧化技术在块体Ta表面构建纳米管的研究已有广泛报道,但针对多孔Ta表面的阳极氧化技术鲜有研究。一方面,Ta金属表面纳米管薄膜的生长机理还处在摸索阶段;另一方面,3D打印多孔金属内部复杂的三维结构使得阳极电场分布不均匀。而氧化过程中纳米管薄膜的形成来源于TaOx持续形成和溶解之间的相互竞争关系,纳米管在阳极氧化过程中是一个不断生长和溶解的动态过程,这将导致在相同氧化时间下,多孔金属表面出现局部纳米管刚刚形成,而其他区域纳米管已经坍塌的不均匀现象。因此,需针对多孔金属进一步优化阳极氧化的工艺参数,以构建均匀的纳米管薄膜。
1.2 碱热处理
碱热处理是一种简单、经济的表面改性技术,常用于提高金属骨修复材料的表面生物活性。碱热处理指金属材料经NaOH溶液浸泡后在高温下进行热处理的过程。在此过程中,Ta植入体表面的钽氧化物与Ta基体依次与NaOH溶液反应形成一层无定形的钽酸钠,并通过热处理加以稳固[27-28]。只有在适当的NaOH浓度下能够保证Ta的生物相容性,同时提高其生物活性。Lin等[29]将Ta在1.0M的NaOH中进行碱热处理后,表面出现了结晶钽酸钠相(Na5Ta11O3),严重影响了MG63细胞的增殖活力。碱热处理一般用于其他表面改性技术的预处理,以提高材料表面的生物活性。如经过碱热处理后的Ta表面带负电荷,可以在生理体液中与带正电荷的Ca2+结合形成无定形的磷酸钙,有利于提高种植体早期的骨整合能力。
1.3 仿生无机涂层
仿生无机涂层主要指磷酸钙(CaP)基涂层,因具有与天然骨相似的无机成分而被广泛用于修饰金属植入物表面。Ta表面的CaP涂层一般通过两种方式得到:以有机涂层(如有机硅烷、有机磷酸盐)作为磷灰石成核剂[30-31];通过尿素介导的非均相矿化,使用羟基磷灰石的酸性溶液促进磷灰石的成核和生长[32]。经过活化后的Ti、Zr、Nb或Ta金属表面能够在模拟体液(SBF)环境中形成仿生磷灰石,其晶体在结构上比羟基磷灰石、磷酸三钙和磷酸四钙更接近天然骨矿物[33]。Barrère等[14]将多孔Ta浸泡在5倍浓度的SBF中,37℃下放置24h后形成均匀的无定形磷酸钙盐薄层,以作为后续结晶层生长的播种层。继续浸泡在含有晶体抑制剂(Mg2+、HCO)的改性SBF中,得到30μm厚的碳酸磷灰石涂层。与未修饰的多孔Ta相比,仿生磷酸钙涂层多孔Ta植入山羊背部肌肉内12周后出现异位成骨,植入山羊骨干后的骨接触率显著提高,骨长入速度明显加快。
将碱热处理与磷酸钙沉积技术相结合,可以在Ta植入体表面制备一层更有效的仿生磷酸钙层。经碱热处理后,Ta基体表面形成的非晶态钽酸钠与SBF中H3O+交换形成Ta—OH基团,能够与SBF中的Ca2+和磷酸盐离子反应,促进Ta表面磷灰石形核,形成无定形的钽酸钙。随后,钽酸钙进一步转化为磷酸钙[34]。其中,Ta—OH基团是影响Ta表面磷灰石形成的关键,其形成速率决定了Ta表面磷灰石层形成的速率。Miyazaki等[15]发现,在相同条件下,碱热处理可以加快Ta表面形成Ta—OH基团的速度。
1.4 有机涂层
有机涂层改性一般通过天然细胞外基质蛋白质或短肽序列等细胞黏附分子使生物材料功能化。这些配体通过整合素受体与细胞相互作用,从而触发细胞的黏附及机械转导信号,并促进细胞迁移、增殖和分化。精氨酸–甘氨酸–天冬氨酸(RGD)广泛存在于纤连蛋白、骨桥蛋白等细胞外基质蛋白中,能够特异性结合成骨细胞上的整合素亚基,被广泛用于金属材料的功能化改性。Mas-Moruno等[35]通过物理吸附和烷基化的方式将RGD固定于Ta表面,与未经修饰的Ta相比,其表现出更好的细胞黏附能力。Wang等[36]将环RGD修饰的多孔Ta支架应用于兔桡骨阶段性骨缺损模型中,分别在4、8、16周时与无涂层的多孔Ta进行对比,发现新生骨量和骨成熟度显著提高。
在弱碱条件下接触空气时,多巴胺(DA)可在几乎任何固体表面形成聚多巴胺(PDA)纳米膜[37]。PDA结构中存在儿茶酚基团,能够快速覆盖多孔结构的所有内表面,是一种简单、高效的有机生物涂层材料。PDA通过表面丰富的活性官能团与生物分子发生迈克尔加成反应或席夫碱反应,充当活性生物分子的载体,从而引入一些生物活性金属离子。Sr和Mg作为人体必需微量元素,具有促进血管和骨生成的能力。人体内超过60%的Mg聚集在骨骼和牙齿中,Mg2+能够进入DRG神经元,促进降钙素基因(CGRP)的释放,激活骨膜来源干细胞(PDSCs)表面CRGP受体,通过环磷酸腺苷(CAMP)触发CREB1磷酸化,促进成骨分化基因的表达[38]。Ma等[19]通过多巴胺自聚合过程,成功将Mg2+掺杂在SLM制备的多孔Ta支架表面,体内和体外成骨及成血管作用均得到了改善。Sr2+与Ca2+具有相似的特性,因此可以参与骨代谢中一些由Ca2+主导的成骨过程。适量的Sr2+通过激活钙敏感受体(CaSR),增加OPG的产生并降低RANKL的表达,从而促进成骨细胞的增殖、分化,诱导破骨细胞凋亡,刺激骨形成、抑制骨吸收,使骨量增加[39-40]。同时,Sr2+还可以通过调节巨噬细胞表型促进生物材料的早期血管化。Cheng等[41]通过多巴胺自聚合方法,将Sr2+引入SLM多孔Ta表面(PTD–Sr),Sr2+掺杂多孔Ta支架在14天内Sr2+释放稳定,促进了成血管和成骨相关RNA的表达。在大鼠髁骨缺损模型中,与对照组相比,PTD–Sr缺损区域内新骨形成显著增强,表现出优异的血管生成行为。然而,PDA在生物体内的长期稳定性和毒性等关键问题仍有待研究。
1.5 缓释给药涂层
缓释给药涂层的构建通常利用生长因子、细胞外基质蛋白、多肽或药物对植入物表面进行修饰,使其成为具有特定功能的表面[42]。多孔Ta具有良好的抗腐蚀能力,是理想的药物负载支架,其表面的微孔形貌不仅能通过骨长入增强骨整合能力,还能够通过自组装膜和掺入药物实现功能化,以获得缓释能力。通过缓释给药载体控制生物活性分子的降解,负载药物持续有效地释放到邻近的骨组织,减少了常规给药的副作用,有效提高了种植体与宿主骨早期的稳定性。药物与多孔Ta的结合一般通过两种方式实现:通过物理化学相互作用吸附药物;利用聚合物涂层包覆药物。
Ta的三维结构为药物的运输和释放提供了条件,相比于致密块体金属,多孔金属更有利于药物的保留[20,43]。Sautet等[20]首次实现了多孔Ta圆柱体对抗生素的装载和逐步释放,体外浸泡结果表明,一个1cm3的Ta圆柱体能够从1g万古霉素中吸收和释放至少20mg。多孔Ta的此类特性可能有助于预防或治疗假体周围关节感染。该方法虽然方便简单,但存在载药剂量有限、释药时间短等缺点。Garbuz等[44]设计了一种用于局部递送阿仑膦酸盐的多孔Ta支架,将包覆钙的多孔Ta置于阿仑膦酸盐缓冲液中,室温下固定7天。体内实验结果显示,局部释放的阿仑膦酸盐能抑制破骨细胞活性,使成骨细胞活性增强,支架表面有更多新骨形成,有利于种植体的生物固定。
生物聚合物在生理环境中具有生物降解性和生物相容性,适合作为多孔Ta上包覆和递送药物的基质,从而实现药物释放的有效控制。Guo等[21]通过在多孔Ta植入物表面静电自组装透明质酸、甲基化胶原和三元共聚物,将抗癌药物阿霉素封装到多孔Ta植入物上的多层共聚物膜中,使多孔Ta获得持续的药物传递能力。实验证明,阿霉素释放有效期长达一个月,能够抑制软骨肉瘤细胞系(SW1353)的增殖。这种功能化的植入物可以作为一种局部、持续的给药缓释系统,用于骨肿瘤的重建手术治疗。Mckenzie等[45]将唑来磷酸载入多孔Ta中,植入犬股骨6周后发现假体侧和非假体侧的药物浓度分别为732.6、5.8~7.0ng/g,52周后分别降至377.2、1.9~7.1ng/g。说明多孔Ta不仅可以维持局部药物的浓度,还可以有效地将全身药物浓度控制在较低水平,这对预防全身毒性具有重要意义。可生物降解的明胶纳米颗粒(GNPs)是一种多肽聚合物,常作为有效的药物递送载体用于受控和靶向释放。Zhao等[46]在SLM制备的多孔Ta中填充了GNPs水凝胶,以构建细胞外基质的微观结构,将来源于骨髓间充质干细胞的内皮细胞接种于负载GNPs的多孔Ta支架上,植入裸鼠背部皮下组织,术后28天,组织学形态统计显示,该支架可显著促进毛细血管网络的形成。
由此可见,多孔Ta种植体对各种药物和细胞因子的负载依托于表面开放的微孔形貌和内部互连的三维结构,通过表面功能化可实现系统性慢性疾病种植修复的初期稳定性和长期骨整合,在人工种植体局部载药方面展现出巨大潜力。然而,如何构建合适的药物载体,在体内保持载药涂层的生物活性和稳定性,控制药物及活性因子的释放速率仍是当前面临的主要问题。
1.6 抗菌涂层
多孔材料本身容易成为负载细菌的载体,增加感染发生的风险。由细菌感染导致的种植体周围炎需要进行二次手术返修,给患者带来身心负担。因此,开发抗菌功能化的骨缺损修复材料具有重要意义。目前,针对AM多孔Ta进行抗菌性能改性的研究鲜有报道。一方面,多数研究对Ta本身是否存在抗菌性能仍存在争议,认为Ta化学性质稳定,表面易形成Ta2O5氧化层,即便在体内也不易解离出Ta5+,因此不具有抗菌性能[47];另一些研究认为,多孔Ta的抗菌性能与表面形成的Ta2O5有关,且非晶态的Ta2O5具有很好的抗菌性能,但并未说明其潜在抗菌机制[48-49]。另一方面,AM多孔金属具有相对于传统二维材料更大的比表面积和复杂的内部结构,通过给药缓释涂层负载抗生素的方式较为复杂且难以控制体内释放动力学。
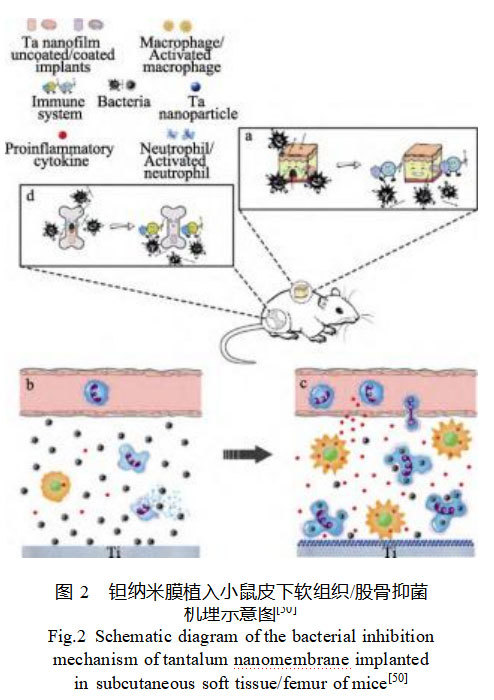
Ta纳米膜已被证实能通过内源性免疫调节而具有抗菌活性和抑制骨溶解的作用,其抗菌机理如图2所示[50]。Ta纳米膜可增强嗜中性粒细胞对细菌的吞噬作用,减少中性粒细胞的溶解,促进巨噬细胞释放促炎细胞因子。这种免疫调节作用有助于宿主消灭细菌,与传统通过毒性作用杀死细菌的抗菌涂层相比更加安全有效。利用AM技术直接制备功能–结构一体化的纳米形貌表面多孔Ta骨科植入物是一种简单、经济的潜在抗菌策略。
2 拓扑结构优化
理想的骨修复支架至少需要具备3个要素:1)良好的生物相容性;2)与天然骨组织匹配的力学性能;3)有利于细胞黏附、增殖和分化,允许营养物质和代谢废物运输的高度连通的多孔结构[51]。AM多孔Ta的拓扑结构与其力学、理化和生物学性能密切相关。此外,AM技术可以精确地在支架表面产生单一或梯度的几何特征,这些拓扑修饰采用微纳米尺度的凸起、凹坑或沟槽形式,通过使整合素聚集形成黏着斑来改善细胞黏附并指导干细胞分化[52-53]。从宏观角度来看,支架的整体结构、造孔单元、孔隙连通率、孔隙率和孔径分布等因素共同参与调控骨组织向支架内生长的进程。从微观角度来看,蛋白质在材料孔隙中的吸附和保留将决定随后的细胞黏附,支架的微纳结构可进一步影响细胞的增殖行为及特定的基因表达。
2.1 孔径
多孔支架通过流体介质的扩散和渗透作用来进行营养物质和代谢废物的运输、细胞的增殖和分化、细胞间信号的传导及毛细血管的形成,因此,孔径是设计多孔植入体的重要参数。研究表明,多孔结构孔径范围在150~1000μm内可促进骨长入;孔径大于300μm可在其内形成血管化骨组织;50~150μm的孔径会导致类骨质生长;而孔径小于50μm的多孔结构只能形成纤维组织[54]。孔径过大或过小对骨修复能力都会产生不利影响,孔径过大会使骨组织与多孔支架界面距离过大,不利于骨组织愈合;孔径过小会导致应力屏蔽现象,使种植体与宿主骨的模量不匹配,导致宿主骨溶解、种植体失效。适当的孔径能够与周围骨骼的刚度接近,使植入体有效地传递载荷,减轻应力屏蔽效应。Luo等[55]利用SLM技术分别制备了孔径为100~200、200~400、400~600、600~800μm的多孔Ta,体内、体外研究表明,孔径为400~600μm的多孔Ta支架具有更好的成骨和血管分化潜能,表现出最好的骨修复效果。Wang等[56]发现,相比孔径为800、900μm的支架,孔径为1000μm的多孔Ti6Al4V支架在体内具有更好的骨再生和促血管生成能力。
2.2 孔隙率
孔隙率为固体结构中孔隙空间的百分比,支架的孔隙率是局部控制力学性能和渗透性的关键参数[9]。人体松质骨的孔隙率在30%~95%之间,为多孔种植体孔隙率的设计提供了标准。体内多孔植入物的骨再生涉及周围骨组织细胞的募集、渗透及血管化[54]。大量的体外和体内生物学实验表明,相对较高的孔隙率一方面有利于细胞增殖、骨长入及血管化过程,但另一方面也会降低多孔植入物的力学性能。Gao等[57]通过SLM技术制备了孔隙率分别为65%、75%、85%的多孔Ta支架,发现支架的压缩强度和弹性模量均随孔隙率的增大而升高。而较高的孔隙率具有较好的渗透性能,有利于营养物质和代谢废物的运输,并能进一步促进骨组织的长入和血管化进程。Wauthle等[8]首次将孔隙率为80%的AM多孔Ta应用在大鼠截断性骨缺损模型中,其表现出良好的体内成骨性能,且植入物与骨界面有较强的连接性。Cheng等[58]制备了孔隙率为15%~70%的多孔Ti6Al4V,结果表明,早期分化标志(碱性磷酸酶)的含量随孔隙率的增大而降低,而晚期分化标志(骨钙素、骨保护素、血管内皮生长因子和骨形态发生蛋白)含量随孔隙率的增大而升高,并认为高孔隙率的结构能够刺激成骨分化。然而,孔隙率对成骨的影响在体内表现出相反的趋势,低孔隙率支架的碱性磷酸酶活性和骨钙素表达量都更高[59]。需要注意的是,体内、体外结果的差异可能是因为体外静态的细胞培养方式无法模拟体内复杂的生理环境。由此可见,支架的孔隙率设计通常涉及体内许多复杂且相互冲突的特性和要求。例如支架的渗透性和刚度相互竞争,通常以较低的机械强度为代价获得较大的孔隙率,因此,在保持力学性能适宜的同时使支架满足一定的传质要求,需要在支架的孔隙率和强度之间找到一个平衡关系。
2.3 孔隙几何形状
孔隙的几何形状通过一定的排列方式形成三维支撑结构,对多孔植入体的力学性能、成骨性能和血管化具有重要作用。多孔植入体可根据孔径几何形状分为网状晶格、随机晶格或功能分级晶格。
网状晶格指通过晶胞按所需尺寸在三维空间重复,从而形成规则的种植体结构。传统骨缺损种植体一般为网状晶格,大多采用均匀、规则的几何体,虽然满足了少部分松质骨的生物力学性能,但与人体不同部位的骨骼结构和生理功能存在显著差距。目前关于AM技术制备多孔Ta的研究中,网状晶格主要包括菱形十二面体、金刚石、简单立方等结构,其中菱形和菱形十二面体已被证明相比于其他结构具有更低的刚度,但相同情况下不能承受同样大的压缩载荷[60]。此外,三重周期最小表面(TMPS)晶胞结构也是网状晶格的一个子集,在三维方向上曲率为0,具有轴对称刚度、高比表面积和孔隙连通性,在生物性能和力学性能方面表现出优越性[61-62]。
传统利用化学气相沉积(CVD)制备的多孔Ta结构大多为随机晶格结构。借助计算机建模和数学算法也能在AM技术中获得随机晶格结构。随机晶格又称“不规则”或“骨小梁”晶格,没有固定的重复单元晶格结构,可使用仿生原理模拟人体的骨小梁结构,其机械性能模仿了骨小梁在人体中的受力情况[63-64]。Wang等[56]利用电子束熔化技术(EBM)分别制备了规则和不规则结构的Ti6Al4V,发现相比于规则孔径结构,不规则孔径结构更有利于骨髓间充质干细胞(BMSCs)的黏附、增殖和分化,且其中较大孔径的支架有利于血管生成相关基因的表达。植入兔胫骨中12周的结果表明,不规则结构和较大孔径更有利于血管形成和骨组织长入,有利于大尺寸骨缺损的修复。
人体骨骼本身就是一个功能分级系统,如从皮质骨到松质骨结构的变化是渐进的,孔隙分布的平滑变化决定了其力学性能的渐进变化。某些特性(如材料成分、孔隙特征)在设计空间中呈梯度变化,以实现一个或多个功能的支架称为功能梯度支架[65]。此类功能梯度支架在适应体内复杂载荷时能够减轻应力屏蔽效应,提供选择性生物活性,并适应宏观骨几何学变化。
需要注意的是,由于不同材料固有属性的差异,同一套拓扑结构参数在不同材料中无法获得相同的效果。尽管目前已对生物医用钛合金拓扑结构与生物学性能的优化进行了广泛而深入的研究,然而孔隙结构对多孔Ta的力学性能、生物相容性和骨整合效果的影响尚未得到充分研究。建立AM多孔Ta拓扑结构与生物力学、骨整合的适配关系是未来发展的重要方向。
3 总结与展望
近年来,AM多孔Ta在各种动物骨缺损模型研究和临床报道中表现出相对于传统骨科植入物更加出色的成骨能力,具有优异的临床应用潜力。相关报道显示,骨缺损患者仍然面临着骨整合不良、细菌感染、无菌性松动等风险。结合多种表面改性技术和拓扑优化手段是赋予AM多孔Ta骨整合能力、抗菌性能、促血管化性能以解决上述问题的关键。
AM多孔Ta具有相对于传统二维材料更大的比表面积和复杂的内部三维结构,一方面使其在表面改性技术应用中具有一定优势,如通过阳极氧化和碱热处理能够形成与人体骨骼结构相似的仿生微纳梯度结构表面,在缓释给药系统中具有吸附药量大、缓释时间长等优点。另一方面,其复杂的三维结构也限制了一些表面改性方法的应用,如通过阳极氧化技术无法在多孔Ta表面及孔隙内部形成均匀的纳米管薄膜,一些功能化涂层也无法均匀覆盖并渗透进多孔Ta内部孔隙中,难以与基体表面形成稳定结合。因此,对于其表面改性方法的研究大部分只停留在体外实验或体内短期的动物模型研究中。表面改性技术已在二维材料中广泛应用,随着生物材料支架在组织工程中的作用越来越重要,有必要将表面改性技术的应用转移到三维空间。未来仍需进一步控制表面改性技术的条件并优化工艺参数,充分发挥多孔Ta的性能和结构优势,针对患者的特定需求构建多功能的骨缺损修复支架。
局部给药系统的发展为AM多孔Ta骨科治疗领域提供了一个创新、有效的方向,但这一领域的探索相对较少。各种抗生素或抗肿瘤药物是否会影响AM多孔Ta的性能从而影响骨整合尚不清楚,未来应聚焦于AM植入物及其载药系统之间的协同作用和整体性质。目前,多种抗菌及抗肿瘤药物的负载已在钛种植体上得到实现,但针对以Ta为载体的研究较少,原因可能是Ta成本高、加工难度大。涂覆Ta涂层的AM多孔钛有望解决这一问题,但其是否具有与AM多孔Ta相当的生物相容性和骨整合性能,以及体内的涂层结合强度问题仍然有待研究。
AM技术在个性化设计和控制孔隙特征方面功能强大,使得拓扑结构优化成为实现骨科植入物功能化的又一途径。其相互连通的孔隙结构为骨组织的长入和血管化进程提供了空间。孔隙率、孔径、孔隙几何形状是AM多孔Ta重要的结构参数,当这些参数选择适当时,可促进多孔Ta种植体的血管化和骨组织长入,并与宿主形成生物学连锁,确保其长期体内稳定性。然而,最佳的结构参数目前尚未确定,笔者认为开发功能梯度材料以满足特定的需求是未来研究的重点。此外,可以结合有限元分析(FiniteElementAnalysis,FEA)和拓扑优化技术(TopologicalOptimization,TO)进一步优化结构和3D打印参数,以建立AM多孔Ta拓扑结构与力学、体外生物学、体内骨长入的适配关系。
目前,大多数有关AM多孔Ta表面改性和拓扑结构优化的研究主要集中在体外生物学实验和小动物骨缺损模型上,与临床应用有较大差距。此类功能化AM多孔Ta植入物在体内的安全性和有效性仍需要严格、长期的评估,这对于研究人员和外科医生来说依旧任重道远。
参考文献:中图分类号:R318.08文献标识码:A文章编号:1001-3660(2023)07-0001-10
DOI:10.16490/j.cnki.issn.1001-3660.2023.07.0013D打印多孔钽表面改性及功能化研究进展
星尘科技(广东)有限公司是国内采用射频等离子体球化技术批量生产医用级球形钽粉的领先企业。球形钽粉具有高纯度、低含氧量、优异球形度及良好流动性等特点,非常适合3D打印精密医疗植入物,如骨钉、骨板及关节假体。该材料出色的生物相容性能促进骨骼愈合,公司已参与制定多项医疗植入物国家标准,并协助完成超500例钽骨科植入体临床应用。更多资讯,欢迎联系郑经理13318326187.

相关新闻

