钛钽合金表面改性处理及其体外成骨生物活性
发布时间:
2025-07-23
由先天性骨病、创伤、感染等导致的骨缺损是临床常见病症,通常需要植入骨修复材料加以治疗[1]。视材质的不同可将骨修复植入材料分为金属、高分子和陶瓷3类[2],其中金属材料因力学性能良好和相对容易加工而成为优选。在众多生物医用金属材料中,钛及其合金具有综合力学性能优、耐腐蚀能力强、生物相容性好、易加工成型和价格便宜等诸多优点而备受青睐[3-4]。目前已有较多有关钛及其合金材料用于治疗骨坏死、修补骨缺损、髋关节置换等的成功案例[5-7]。与Ti相比,金属钽(Ta)具有更好的化学稳定性和更优异的生物相容性[8],因而近年来成为被重点关注的一种骨修复用新材料。然而,钽资源稀少致其价格昂贵,加之其熔点高使得加工困难,因而极大地限制了其在生物医用领域的推广应用。而将钛和钽通过熔炼和后续加工制成亚稳β型TiTa合金,除可继承两种元素的各自优点外,还具有优异的塑性和与人骨组织更为接近的弹性模量,这些特点使其成为人体硬组织修复和替代的潜在候选材料[9-11]。然而,值得注意的是金属钛或钽自身的表面促成骨生物活性有限,它们在植入生物体后与周围骨组织间建立起稳定化学键合的时间较长。因此,为了降低植入体在植入早期可能因发生移位和松动而导致植入手术失败的风险,对钛或钽进行表面处理以提高其生物活性进而加速与骨组织间的整合非常必要。在植入体表面构建具有类骨组织成分的羟基磷灰石涂层(hydroxyapatite,HA)是快速提升其成骨生物活性的最直接方法。然而采用诸如等离子喷涂[12]、生物仿生[13]、电化学沉积[14]等方法制得的HA涂层,或因涂层中存在热应力或因与基体结合强度低而使得它们在植入生物体内后易出现分层破裂或脱落,进而影响临床使用效果。因此,通过化学或电化学[15-16]等手段来破坏生物医用金属表面原有的致密钝化膜结构并重新构筑出生物活性薄膜作为过渡层,借此实现生理环境下钙、磷等离子被诱导以HA的形式在基体表面快速沉积,继而建立起植入体与人体硬骨组织间的牢固骨性结合,日益受到人们的重视。
本工作选择TiTa合金作为研究对象,通过简易的氢氧化钠水热处理一步法或水热-预钙化处理两步法对其进行表面改性,随后借助模拟体液(simulatedbodyfluid,SBF)浸泡实验对改性TiTa合金的体外成骨生物活性进行评价,并结合实验结果对成骨生物活性的提升原因进行分析,期待为该合金的临床应用提供有价值的参考。
1 实验材料与方法
1.1 试剂
氢氧化钠(NaOH,AR)、无水乙醇(CH3CH2OH,AR)、氯化钠(NaCl,AR)、碳酸氢钠(NaHCO3,AR)、氯化钾(KCl,AR)、三水合磷酸氢二钾(K2HPO4•3H2O,AR)、六水合氯化镁(MgCl2•6H2O,AR)、氯化钙(CaCl2,AR)、硫酸钠(Na2SO4,AR)、盐酸(36%~38%,质量分数,下同,HCl,AR)、三羟甲基氨基甲烷(C4H11NO3,Tris,AR),上述试剂均购自上海泰坦科技有限公司。实验用水均为自制去离子水。
1.2 材料制备
使用600#的耐水砂纸对10mm×10mm×2mm尺寸的钛钽合金(Ti:Ta=43:57,质量比)进行打磨,以除去表面惰性氧化层。随后依次在去离子水、无水乙醇中超声洗涤5min,以除去表面油污。将洗涤后的TiTa合金移入装有30mLNaOH溶液(1mol/L)的100mL聚四氟乙烯水热釜中,密封后于70℃下反应24h。待反应结束后,将TiTa合金取出并用去离子水多次浸泡、洗涤,以除去样品表面残余溶液。将一部分样品于50℃下干燥后保存,另一部分样品则继续进行预钙化处理。
预钙化处理过程:将NaOH处理过的样品放入40℃的饱和氯化钙溶液中浸渍12h,然后用去离子水洗涤,转移至40℃的K2HPO4•3H2O溶液(1mol/L)中浸泡4h,取出样品并用去离子水洗涤后于50℃烘干。
1.3 分析表征
借助X’PertPro型掠入射X射线衍射仪(GIXRD)对样品的晶相结构进行表征,掠入射角度为1.5°,Cu靶,Kα射线,扫描角度为10°~75°,扫描步速2(°)/min。使用Quanta600F型场发射扫描电镜(FESEM)和其附属的X射线能谱仪(EDS,Oxford)对样品的形貌和元素成分进行分析。样品的化学成分和元素价态通过KratosXSAM-800型X射线光电子能谱仪进行分析,Al靶,Kα射线作为发射源。使用DropMeterTMA-200型仪器对样品的静态水接触角进行测量。
1.4 体外生物活性评价
采用SBF浸泡实验对一步法水热改性和水热-预钙化两步法处理所得样品的体外成骨生物活性进行评价。SBF配制方法[17]:将8.035gNaCl,0.355gNaHCO3,0.225gKCl,0.231gK2HPO4•3H2O,0.311gMgCl2•6H2O,39mLHCl(1mol/L),0.292gCaCl2,0.072gNa2SO4和6.118gTris依次溶于约940mL去离子水中,随后逐滴滴加1mol/LHCl,将溶液的pH值调至7.40(37℃)并定容至1L。将改性样品放入50mLSBF中置于37℃恒温箱中进行培养,培养至预定的时间后,将样品取出并用去离子水清洗,烘干后用于后续表征分析。培养过程中每间隔24h需更换一次SBF。
2 结果与分析
2.1 形貌分析
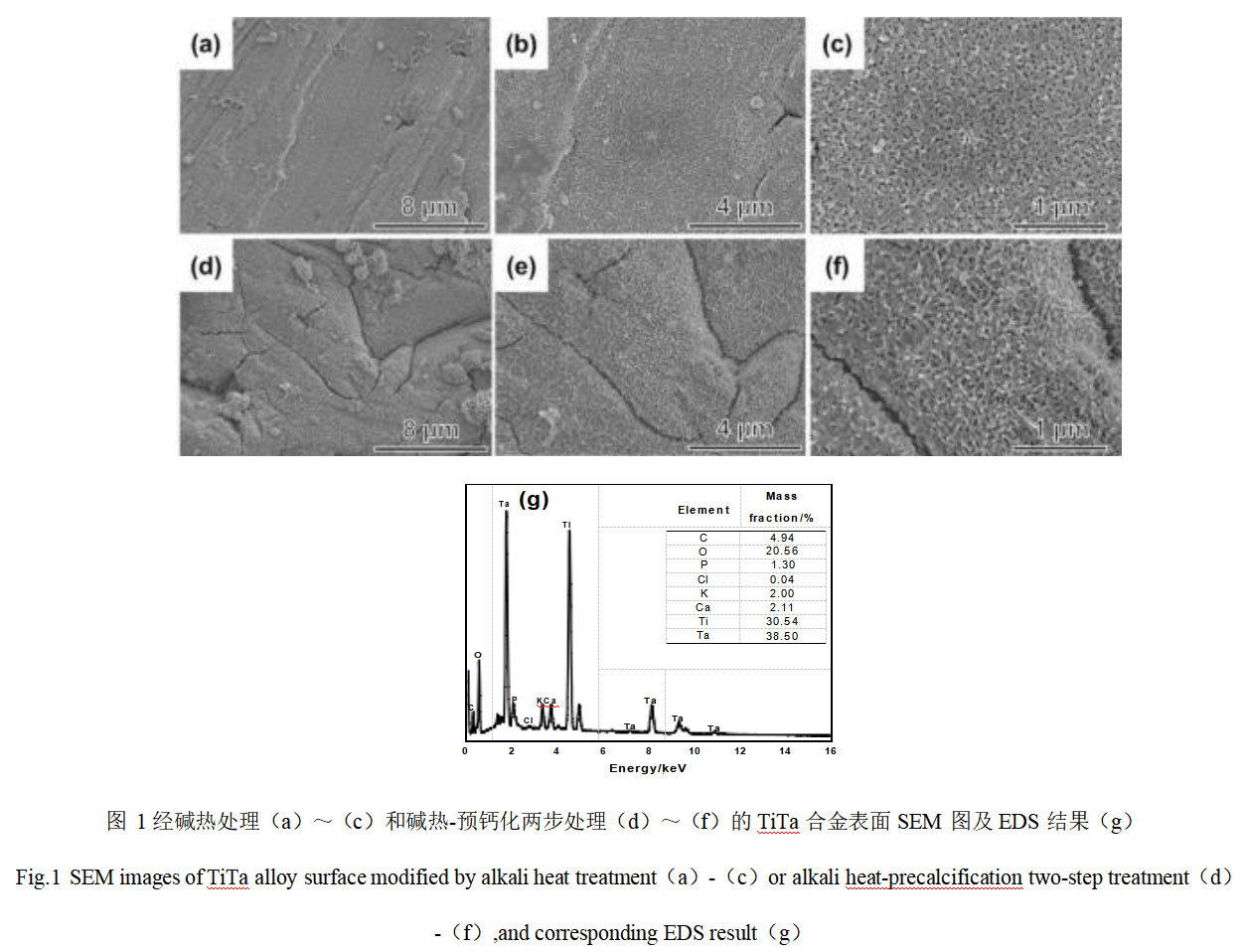
图1是TiTa合金经过碱热处理和碱热-预钙化两步处理后表面的SEM图及EDS分析结果。由图1(a),(b)可知,TiTa合金于1mol/LNaOH溶液中水热处理24h后,其表面有一层连续致密的膜生成。高倍显微照片显示(图1(c)),该膜层较为粗糙,由众多细小纳米线组装而成,呈现出网状多孔结构。图1(d)~(f)为TiTa合金经过水热-预钙化两步处理后表面的SEM图。与一步水热处理的样品对比可知,预钙化处理对样品的形貌基本上没有影响。图1(g)为两步法改性处理TiTa合金表面EDS分析结果。除检测到Ta、Ti、O元素外,还检测到Ca、C、P、K元素,表明通过后续预钙化处理成功在经碱热改性生成的网状膜层中引入Ca、P等元素。
2.2 晶相分析
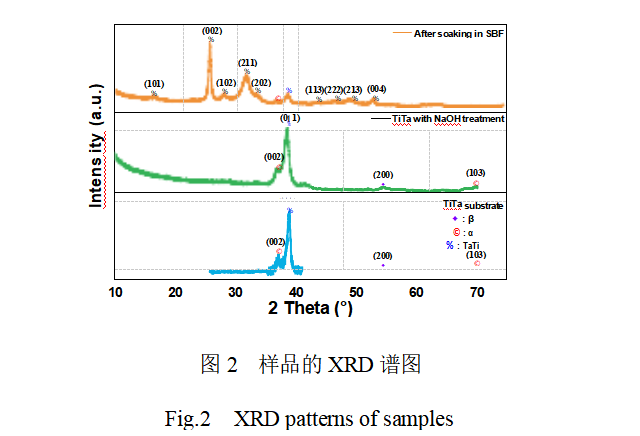
图2为未改性TiTa合金、碱热改性TiTa合金及碱热-预钙化改性TiTa合金经SBF浸泡培养后表面膜层的XRD谱图。可知,未改性处理的TiTa合金在2θ=38.72°处有一强衍射峰,对应于TiTa金属的(011)晶面(JCPDSNo.96-152-8104)。此外,还观察到几个微弱的衍射峰,它们分别对应于金属钛的α相和β相。TiTa合金经碱热改性处理后的XRD谱图与改性前相比变化不大,未观察到有新的晶态衍射峰出现。文献报道[18-19],金属钛或钽经碱热处理后表面会生成钛酸钠或钽酸钠膜,且膜层的结晶状态受实验时的水热处理温度、NaOH浓度等因素影响较大。鉴于本研究中所使用的NaOH浓度和水热温度均较低,因此推测TiTa合金经碱热处理后表面所形成的薄膜是无定型的钛(钽)酸钠。
2.3 XPS分析
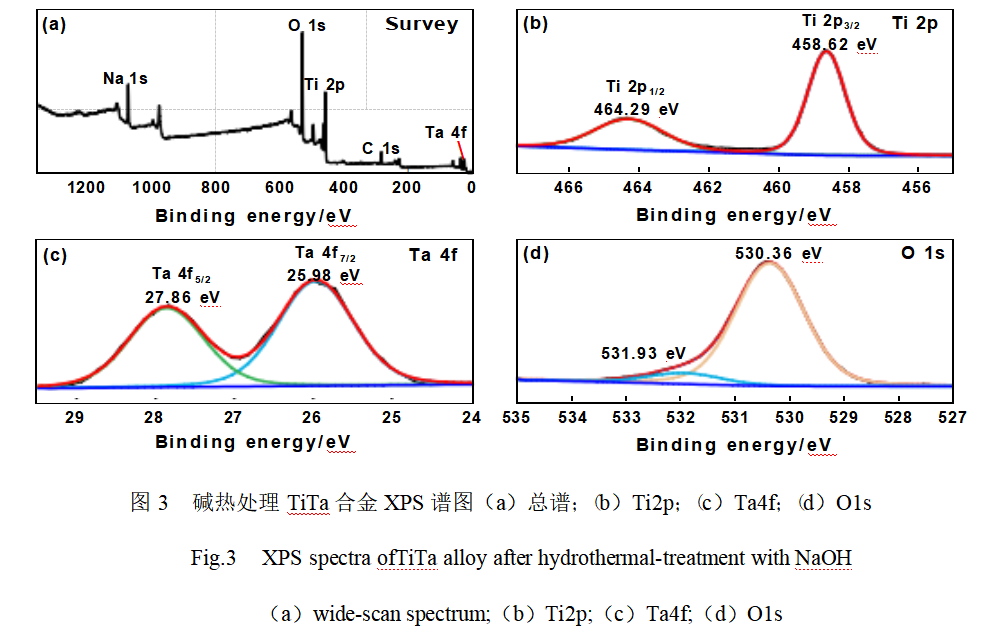
采用XPS对经碱热改性处理TiTa合金表面膜层中的元素组成和化学价态进行分析,如图3所示。由图3(a)可知,在全扫描谱中检测到C1s、O1s、Na1s、Ti2p和Ta4f的特征信号,其中结合能位于284.8eV处的C1s信号来源于检测仪器本身的碳污染。图3(b)为Ti2p的高分辨XPS谱,在电子结合能位于458.62eV和464.29eV处观察到两个信号峰,它们分别归属于Ti2p3/2和Ti2p1/2,且两者的自旋轨道分裂值为5.67eV,证实Ti以Ti4+的形式存在[20]。由Ta4f的高分辨XPS谱图(图3(c))可知,Ta4f7/2和Ta4f5/2峰分别位于25.98eV与27.86eV处,表明Ta以Ta5+的形式存在[21]。图3(d)中O1s的高分辨谱可以拟合为位于530.36eV和531.93eV处的两个峰,它们分别归属于Ti(Ta)-O和表面的羟基物种[21-22]。
2.4 体外成骨生物活性
通常用植入体材料能否在生理环境条件下诱导体液中的Ca2+、PO43-等离子以类骨羟基磷灰石层的形式在其表面沉积来评价其成骨生物活性。因此,对采用不同方式改性处理的TiTa合金样品进行SBF体外浸泡培养实验。图4为碱热改性处理TiTa合金在SBF中浸泡培养不同天数后表面的SEM图及EDS分析结果。由图4(a)~(c)可知,碱热改性TiTa合金在SBF中浸泡9天后的表面形貌与浸泡培养前基本一致,仍为纳米线组成的网状结构,未观察到有新生沉积物出现。当浸泡时间延长至第18天后,如图4(d)~(f)所示,仍未观察到TiTa合金样品的表面形貌发生明显变化。对在SBF中浸泡培养18天后的样品进行EDS面扫,如图4(g)所示,发现除了有C、O、Ti、Ta的强信号峰及Ca的弱信号峰出现外,未检测出P元素,证实碱热改性TiTa合金经SBF浸泡后表面并无类骨组织羟基磷灰石层的生成,表明其成骨诱导性能较差。

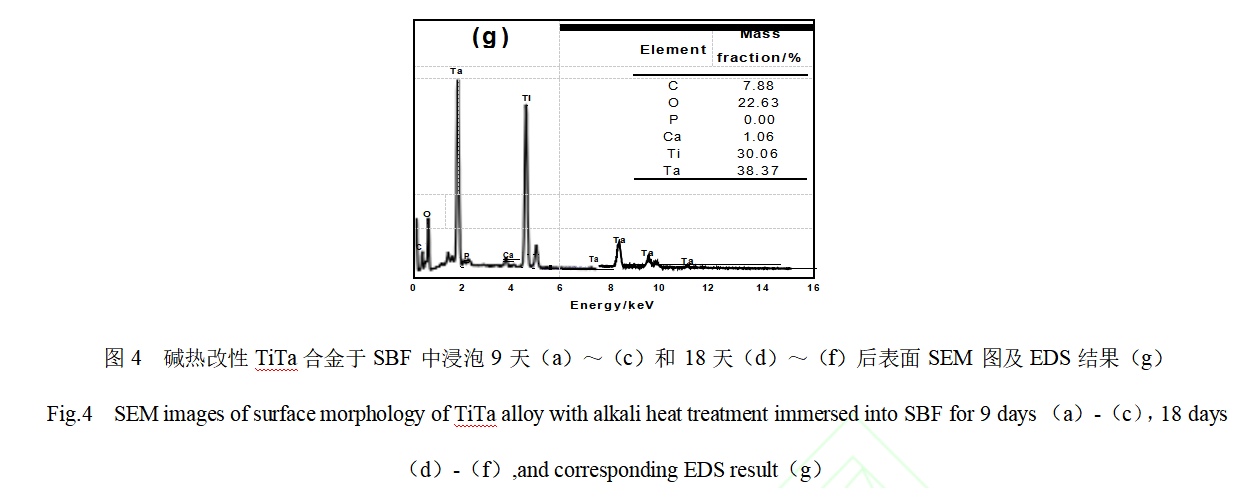
图5是将碱热-预钙化两步法处理的TiTa合金置于SBF中浸泡培养不同天数后表面的SEM图和EDS分析结果。由图5(a)~(c)可知,两步法改性处理的TiTa合金在SBF中浸泡培养1天后,其表面形貌与培养前基本一致,但高倍电镜照片显示(图5(d)),其表面由纳米线组成的网状结构中有新生的沉积物填充。当SBF浸泡时间延长至3天后,如图5(e)~(h)所示,改性TiTa合金表面已完全被直径数微米的新生球簇物质所覆盖。对这些球簇状物质进行放大观察,发现它们是由厚度约25nm的纳米片织连形成的多孔网状结构。此外观察到部分区域的膜层出现裂缝,表明新生成膜层的厚度较大。当SBF浸泡时间进一步延长至5天后,覆盖在TiTa合金表面的球簇更加扁平且球簇间的裂缝变得更宽,表明随SBF浸泡时间的增加所形成膜层的厚度也进一步加大。图5(m)为改性TiTa合金在SBF中培养5天后表面膜层的EDS分析结果。能谱结果显示,在该膜层中检测到Ca、P、O的强信号峰,这与预期的结果一致,表明这些球簇物质可能是羟基磷灰石。生成物的Ca/P质量比为1.84,折算成原子比为1.42,稍低于HA(Ca5(PO4)3OH)的理论钙磷原子比1.67,表明其可能为缺钙磷灰石。此外,还发现来源于基体Ti、Ta元素的EDS信号强度较培养前降低明显,证实在改性TiTa合金表面诱导沉积的HA膜层较厚,这与SEM结果吻合。为进一步确认这些球簇物质的物相组成,对其进行XRD分析,发现2θ=25°~33°范围内出现的强衍射峰与磷灰石(JCPDSNo.09-0432)的(002)、(102)、(211)和(202)晶面匹配良好,证实这些球簇状新生物质层确为磷灰石。从XRD谱图(图2)中还观察到来源于TiTa基底的衍射峰强度明显降低,再次证实在改性TiTa合金表面诱导生成的磷灰石层相对较厚。体外SBF浸泡实验结果表明,相比NaOH水热改性处理的样品,采用碱热-预钙化两步处理的TiTa具有更高的生物活性,其在较短时间即可从SBF中诱导大量类骨组织HA沉积在表面,显示出其作为骨修复材料的应用潜力。

2.5 生物活性增强原因分析
NaOH水热改性辅以预钙化处理提高TiTa合金生物活性的原因为:首先,TiTa合金经氢氧化钠水热处理后,在其表面形成了由纳米线组装而成的多孔网状无定形钛(钽)酸钠膜层,而这种具有多孔、粗糙和复杂界面结构的膜层通常有利于诱导HA的形成[23]。其次,TiTa合金碱热改性前后的静态水接触角分别为(54.92±2.1)°和(11.16±2.4)°,表明TiTa合金经碱热改性后由亲水变为超亲水,这非常有利于SBF溶液在其表面的铺展[24]。再者,TiTa合金经碱热处理后表面含有Ti-OH和Ta-OH官能团,当将其浸泡于饱和CaCl2溶液后,这些官能团将会发生去质子化形成荷负电的Ti-O-和Ta-O-基团,可通过库仑引力吸附Ca2+,从而使TiTa合金带正电荷。随后将其浸泡于K2HPO4溶液中时,其表面荷正电的Ca2+可快速吸附HPO42-,从而完成钙磷化合物的形核。众所周知,SBF是含有Ca2+、PO43-等离子的过饱和溶液,预钙化处理后的TiTa合金,由于表面已有初始形核的钙磷化合物,浸入SBF中后可快速诱导SBF中的钙、磷等离子以沉淀形式析出,并逐渐转变为热力学最稳定的钙磷化合物HA[25-26]。
3 结论
(1)将TiTa合金置于NaOH溶液(1mol/L)于70℃水热处理24h,在其表面构筑出由纳米线组装而成的多孔、粗糙的无定型钛(钽)酸钠涂层,静态水接触角由水热处理前的(54.92±2.1)°降至(11.16±2.4)°;对碱热改性的TiTa合金进一步预钙化处理,成功在其表面网状膜层中引入Ca、P元素,但其表面形貌未见明显改变。
(2)仅碱热处理的TiTa合金表面成骨生物活性较低,其于SBF中浸泡18天仍未能诱导磷灰石层生成;而经碱热-预钙化两步法处理的TiTa合金于SBF中浸泡仅3天,其表面即可被致密的球簇状羟基磷灰石涂层完全覆盖,表现出优异的体外成骨生物活性。
(3)碱热处理所形成的多孔、粗糙和超亲水的表面结构以及进一步预钙化引入的钙磷化合物初始晶核等因素的共同作用是改善TiTa合金成骨活性的原因,碱热-预钙化处理可推广用于其他生物医用钛合金的表面改性。
参考文献:邹勇,廖小刚,余姿,李纲,田甜.钛钽合金表面改性处理及其体外成骨生物活性[J/OL].材料工程
星尘科技(广东)有限公司专注于高端球形钛钽(Ti-Ta)合金粉的研发与生产,提供Ti-75Ta、Ti-50Ta、Ti-60Ta等多种比例定制化产品。采用射频等离子体球化技术制备,具有高纯度(低氧含量)、球形度高、无卫星球、流动性优异及高振实密度等特性。微观组织以β相为主,细粒径粉末含马氏体α"相,硬度随粒度减小而提升。产品适用于3D打印(SLM成形致密度>99%)、骨科植入物(弹性模量接近人体骨骼)及航空航天领域。更多详情,欢迎联系我们的专业人员,郑经理13318326187.

相关新闻
星尘科技(广东)有限公司

佛山市南海区丹灶镇南沙社区森树基路10号联东优智园1座101号
二维码

